Enero, 2023
Una de las tijeras genéticas CRISPR más conocidas utiliza la proteína Cas9 para seccionar el genoma del virus invasor en zonas concretas. Ahora, investigadores estadounidenses y alemanes han identificado otra, llamada Cas12a2, que corta de forma indiscriminada las moléculas de ADN y ARN de la propia célula infectada hasta acabar con ella. El hallazgo podría aplicarse en el diagnóstico de enfermedades víricas.
CRISPR es el acrónimo —propuesto por Francis Mojica— de lo que en español son las ‘repeticiones palindrómicas cortas agrupadas y regularmente espaciadas’, en realidad sistemas inmunitarios bacterianos. En las dos últimas décadas ha cautivado la imaginación de científicos y profanos por su potencial para editar genes, y ha valido un Premio Nobel para Jennifer Doudna y Emmanuel Charpentier.
Ahora, investigadores de Estados Unidos y Alemania describen en dos artículos de Nature la estructura y función de un sistema inmunitario CRISPR recién descubierto que, a diferencia de otros más conocidos que desactivan genes extraños para proteger a las células bacterianas, estos ‘apagan’ a las que están infectadas para impedir que transmitan la infección.
“Con este nuevo sistema, conocido como Cas12a2, observamos una estructura y una función que no se parecen en nada a lo visto hasta ahora en los sistemas CRISPR”, afirma Ryan Jackson, profesor de la Universidad Estatal de Utah (USU) en EUA y coautor de los dos trabajos.
En el estudio participan también otros científicos de la USU, la Universidad de Texas (UT) en Austin, el Instituto Helmholtz de Investigación de Infecciones Basadas en el ARN de Alemania y la empresa de biotecnología estadounidense Benson Hill, que identificó por primera vez la secuencia de aminoácidos de este novedoso sistema inmunitario bacteriano.
En cierto modo es similar al más conocido CRISPR-Cas9, que se une al ADN diana y lo corta —como unas tijeras moleculares—, desactivando de forma efectiva un gen o secuencia concreta. Sin embargo, CRISPR-Cas12a2 se une a una diana distinta y esa unión tiene un efecto muy diferente.
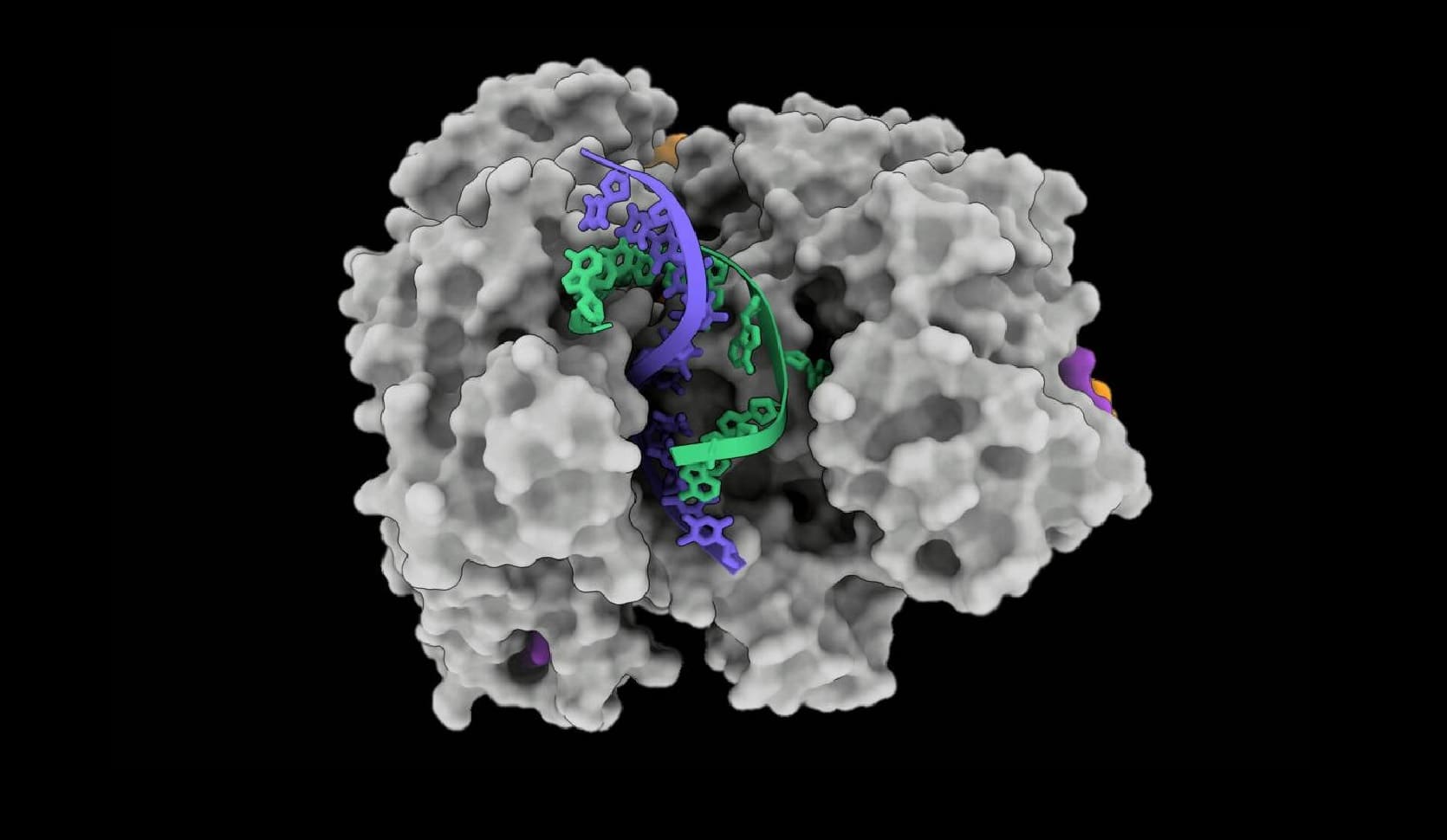
“Cas12a2 se combina con un ARN guía para formar un complejo ribonucleoproteico”, nos explica Jackson en entrevista. “Luego —continúa— este ARN guía dirige el complejo hacia el ARN diana [vírico] con emparejamiento de bases. Cuando el complejo queda unido, el componente proteínico (Cas12a2) experimenta un importante cambio conformacional, que abre una superficie de la proteína (sitio activo enzimático) que se une, dobla y escinde el ADN. Lo parte una y otra vez, haciendo que las células con el ARN diana entren en estado latente o mueran”.
Doblar el ADN sin contemplaciones
“Increíblemente, las nucleasas Cas12a2 doblan 90 grados el trozo normalmente recto de ADN de doble hélice, para forzar la ‘columna vertebral’ de la hélice hacia el sitio activo enzimático, donde se corta”, señala; “es un cambio de estructura extraordinario de observar, un fenómeno que deja la boca abierta a los colegas científicos”.
“Cas12a2 agarra los dos extremos de la doble hélice del ADN y los dobla con mucha fuerza”, añade otro de los autores, Jack Bravo, de UT Austin, “entonces, la hélice se abre en el medio, y esto permite a este sitio activo destruir los fragmentos de ADN que se vuelven monocatenarios. Esto es lo que diferencia a Cas12a2 de todos los demás sistemas dirigidos al ADN”.
Utilizando criomicroscopía electrónica (crio-EM), los autores han demostrado este comportamiento único de CRISPR-Cas12a2, que desencadena la degradación de ARN monocatenario, ADN monocatenario y ADN bicatenario. Se trata de una estrategia defensiva natural de las bacterias y arqueas para limitar la propagación de los virus y otros patógenos.
Diferencias con Cas9
Por comparar con Cas9, “este utiliza un ARN guía para unirse al ADN bicatenario, sin embargo, Cas12a2 lo emplea para unirse al ARN monocatenario”, comenta Jackson, “y una vez que Cas9 se une al ADN, realiza una única rotura en un lugar muy específico, mientras que la unión de un ARN complementario transforma a Cas12a2 en una nucleasa activa que realiza muchos cortes tanto en el ADN como en el ARN. Es una actividad inespecífica, no importa cuál sea la secuencia de bases de estos ácidos nucleicos”.
Además, añade, “en la naturaleza, Cas9 suele estar programada para dirigirse al ADN del virus y cortarlo. Cuando lo consigue, permite que la célula sobreviva. Cas12a2 también está programada para atacar virus, pero al unirse al ARN viral, empieza a cortar todo el ADN de la célula, lo que la ‘apaga’ en lugar de protegerla. El cierre de la célula protege a la colonia bacteriana de la propagación viral”.
Aplicaciones terapéuticas y de diagnóstico
“Si se pudiera aprovechar Cas12a2 para identificar, atacar y destruir células a nivel genético, las aplicaciones terapéuticas potenciales serían significativas”, afirma el investigador. “Sólo estamos arañando la superficie, pero creemos que Cas12a2 podría dar lugar a tecnologías CRISPR mejoradas y adicionales que beneficiarían enormemente a la sociedad”.
De momento estos estudios han sido con cultivos bacterianos y con proteínas purificadas en experimentos de bioquímica, pero actualmente el equipo ya está trabajando para intentar reutilizar Cas12a2 en otros tipos de células, incluidas las humanas. “Ya hemos reutilizado Cas12a2 para poder detectar rápidamente ARN, lo que podría utilizarse en el diagnóstico de enfermedades”, apunta Jackson.
Según los autores, gracias a su capacidad para dirigirse a tantos tipos de material genético, este descubrimiento tiene potencial para el desarrollo de nuevas pruebas diagnósticas baratas y muy sensibles, para una amplia gama de enfermedades infecciosas víricas, como la covid-19, la gripe, el ébola y el zika.
“Si mañana apareciera un nuevo virus, bastaría con averiguar su genoma y cambiar el ARN guía en un test para tener una prueba contra él”, apunta el coautor David Taylor de UT Austin.
Un diagnóstico de este tipo exigiría una investigación aparte y probablemente implicaría recoger saliva o una muestra nasal de un paciente para mezclarla con la proteína Cas12a2 modificada del equipo, un fragmento de ARN guía que actuaría como una ficha policial para identificar un virus concreto, y una sonda fluorescente diseñada para iluminarse cuando se corta su ADN monocatenario. En el futuro podría ser una realidad.
Sacrificar al individuo por el bien de la colonia
Un experto en CRISPR es el investigador Lluís Montoliu, del Centro Nacional de Biotecnología del Consejo Superior de Investigaciones Científicas (CSIC). Por ejemplo, es coautor de trabajos como el publicado esta misma semana sobre la ‘resucitación’ de ancestros de esta herramienta de edición genética. Valora así los avances sobre Cas12a2:
“Existen muchos tipos de sistemas CRISPR-Cas, tanto en bacterias como en arqueas, ambas procariotas. Se cree que más de un 80 % de las arqueas tienen sistemas CRISPR y aproximadamente un 50 % de las bacterias. El sistema Cas12a2 es especial, dado que se trata de una nucleasa capaz de digerir tanto ADN de doble cadena, como ADN de cadena simple y ARN de cadena simple también, tras ser activada por la pequeña molécula guía de ARN.
“Además, estas digestiones, estos cortes los realiza de forma inespecífica, sin atender a secuencias predeterminadas (como sí hace la Cas9). La razón por la cual se comporta de esta manera la han encontrado estos investigadores al descubrir que se trata de un sistema que aborta cualquier posible infección desconectando la célula que resulta infectada, antes de que los virus puedan crecer y multiplicarse en su interior.
“En otras palabras, al detectar la entrada del virus complementario a la guía de ARN, en lugar de simplemente cortar el genoma del virus invasor (como hace la Cas9), la Cas12a2 activa una capacidad de corte inespecífica, general, para toda molécula de ADN y ARN de la célula, incluyendo su propio genoma y sus propios ARN, lo cual lleva a la muerte, al suicidio molecular de esa bacteria, que impide con su inactivación que la infección se propague.
“Una solución ingeniosa adoptada por estos procariotas en los que nunca cuenta el individuo, sino la colonia. En los que es perfectamente posible sacrificar algunos individuos de la colonia en aras de preservar al resto. Nunca dejan de sorprendernos las múltiples soluciones que han explorado las bacterias para hacer frente a los virus que las acechan. Y los sistemas CRISPR, por su versatilidad, son perfectos para desarrollar estas estrategias tan singulares y efectivas”. ![]()